
¿Cómo funciona la batería de una herramienta eléctrica?
Vamos a empezar por lo fácil. En una batería (cargada), los electrones salen del terminal negativo y van hacia el positivo. Así es. Hoy sabemos que ese es el sentido real de la corriente eléctrica. Hace algún tiempo se creía que circulaba al revés, esto es, del borne positivo al negativo. ¡Pero eso ahora no viene al caso...!
De más o menos o de menos a más, al presionar el gatillo de la herramienta el interruptor conecta el circuito. El cable pone en contacto los bornes de la batería. Y, a partir de ese momento, la corriente de electrones recorre el motor, lo hace girar y regresa a casa por la puerta de atrás.
El propósito de este texto no es otro que entender cómo producen corriente eléctrica las baterías. ¡Así que manos a la obra!

- Partes de una batería eléctrica: electrodos y electrolito
- Los electrones de la batería salen al exterior
- Mientras, en el interior de la batería...
- Las reacciones químicas en el ánodo y el cátodo
- Al recargar la batería se invierte el proceso
- Química de la carga y descarga de la batería de iones de litio
- Conclusión
Partes de una batería eléctrica: electrodos y electrolito
Lo mismo da litio que plomo, sal que ácido: pesada o ligera, la batería encierra bajo su carcasa dos piezas llamadas electrodos. Por un lado, el cátodo, polo negativo para los amigos; por otro, el ánodo o polo positivo. Uno y otro electrodo se conectan a las chapitas metálicas que vemos en el exterior de la batería.
Pero volvamos al interior de la batería. Como dos bañistas en una piscina poco profunda, el cuerpo del ánodo y el del cátodo están rodeados por una sustancia que llamamos electrolito.
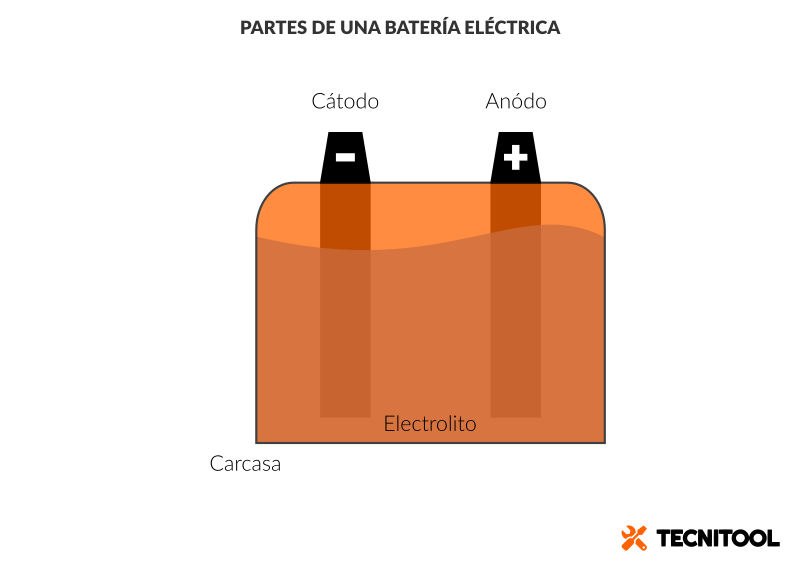
El electrolito no tiene por qué ser acuoso. A veces consiste en una solución líquida de plomo y agua destilada; por ejemplo, es el caso de la batería de arranque del coche. Pero también puede ser una pasta de sales espesa y anhidra (es decir, sin agua) si se trata del acumulador eléctrico de un taladro de batería.
Presentados los actores, esbozado un mínimo escenario y preparados los decorados, podemos izar el telón. Lo que ahora interesa saber es qué papel juega cada elemento en el guion de la batería eléctrica.
Los electrones de la batería salen al exterior
Dentro de una batería cargada los electrones se agrupan en el cátodo (—). En dicho electrodo batería se acumula, pues, un exceso de carga negativa. (Breve recordatorio de química: el electrón es negativo; el protón, positivo).
El ánodo de la batería (+) atrae los electrones. Hacía allí se van a dirigirse, como si fuesen autómatas, en cuanto se presente la ocasión, es decir, cuando se abran las puertas que los retienen. En la batería de nuestra herramienta, sucederá cuando un cable eléctrico conecte entre sí los dos electrodos. Por ejemplo, al presionar el gatillo de un taladro.
¡Clic! Los electrones salen del polo negativo y enfilan por el cable hacia el electrodo positivo. Recorren a su paso las bobinas del motor, las cuales producen un campo magnético que hace girar el motor, que, a su vez, hace rotar el portabrocas. Los electrones regresan a la batería por el polo positivo (+). Sin prisa, pero sin pausa, se concentran en él.
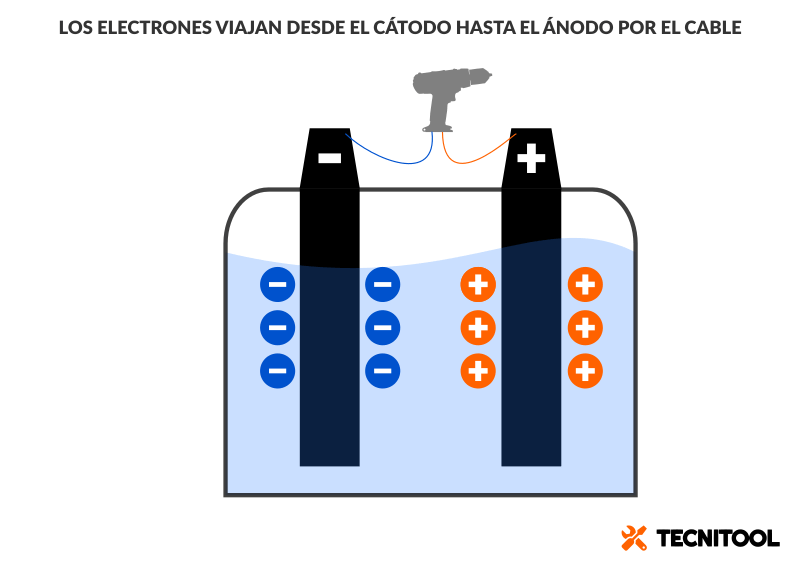
En otras palabras, los electrones se acumulan ahora en el extremo opuesto. Y ya no hay nada que los atraiga.
Para recapitular, la corriente se establece entre los electrodos de la batería porque tienen diferentes cargas eléctricas, una positiva y otra negativa. (Breve recordatorio de magnetismo: los polos opuestos se atraen).
Intermedio. Antes de que la obra prosiga, debemos cambiar el escenario del teatro.
Mientras, en el interior de la batería...
El proceso descrito es similar al funcionamiento de una pila eléctrica primaria (esto es, una pila no recargable). La batería de un taladro eléctrico, no obstante, es una pila secundaria y, por tanto, recargable. Sin embargo, al cargador aún no le toca entrar en escena.
Antes debemos preguntarnos qué ocurría en el interior de la batería mientras los electrones salían al exterior. Se abre el telón. Regresamos a nuestra piscina de electrolito.
Mientras los electrones (—) dejaban atrás la batería por el cátodo, en el interior del acumulador no reinaba la calma. ¡Ni mucho menos! A un tiempo iones positivos de litio (+) buceaban por el electrolito hasta llegar al ánodo. Pero ¿cómo iones? ¿Quién les ha dado vela a los iones en este entierro?
Un ion es un átomo desequilibrado. Cuando le falta un electrón, tiene carga positiva. No hay premio por adivinarlo: si le sobra un electrón, su carga es negativa. Sí por recordar que los electrones (—) fueron en primer lugar atraídos por la carga positiva del ánodo (+).
Pues bien, lo que no se dijo entonces es que esa carga positiva es el resultado de una acumulación de iones positivos en el electrodo.
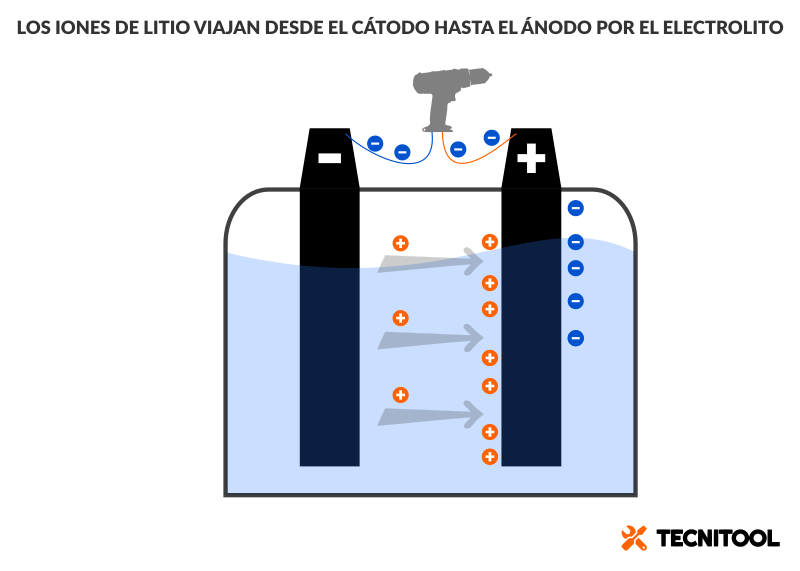
A modo de resumen, cuando una batería se descarga:
- Los electrones viajan del cátodo (—) al ánodo (+) por fuera de la batería (a través del cable y por el motor de la herramienta).
- Los iones positivos viajan del cátodo al ánodo por dentro de la batería.
Todo ello acontece gracias a reacciones químicas entre el ánodo, el cátodo y el electrolito que mantienen la diferencia de cargas. De modo que ahora entra en escena un actor del que aún no habíamos hablado.
Las reacciones químicas en el ánodo y el cátodo
Cuando una batería cargada se conecta a un circuito eléctrico, se produce una reacción química en el interior de la batería. De resultas, los átomos de metal de los electrodos pierden electrones. El electrolito transporta iones de litio desde el electrodo negativo hasta el positivo.
Por el circuito eléctrico, al mismo tiempo, un electrón viaja desde el electrodo negativo hasta el positivo. Así, ambos electrodos quedan compensados. En efecto, se mueven a la vez, por una parte, un atómo al que le falta un electrón (ion positivo) y, por otra, el electrón faltante. El primero por dentro, el segundo por fuera.
Así, en el paso anterior, los átomos quedan con carga eléctrica neutra. Tan solo se han movido del cátodo al ánodo.
Al recargar la batería se invierte el proceso
Ahora sí, vamos con la pregunta obligada. ¿Qué pasa al recargar la batería? Cuando la batería gastada se conecta al cargador y este a una toma de corriente, se invierte el proceso.
En la recarga, una corriente de electrones entra por el polo negativo de la batería. Los iones de litio viajan en sentido opuesto por el electrolito. Así, la batería queda cargada para un nuevo ciclo.

Química de la carga y descarga de la batería de iones de litio
En resolución, la energía que acumula una batería no es eléctrica, sino química. Los compuestos que forman el ánodo y el cátodo cambian de forma al reaccionar. Es la reacción química la que libera los electrones que usan las herramientas sin cable como fuente de energía.
Por consiguiente, de no tratar, aunque sea de forma breve, la química de una batería, este artículo quedaría incompleto. Para ejemplificar, veamos qué sucede con una batería de dioxido de cobalto, litio y grafito. (Uno de los tipos más comunes de batería de iones de litio).
Las reacciones químicas que se dan en la batería de dioxido de cobalto y litio son del tipo redox, es decir, reacción de reducción-oxidación. De esta manera se llaman las reacciones en las que se transfieren electrones entre los reactivos.
Reacción de oxidación (ánodo)
En el ánodo se da una reacción de oxidación. Este electrodo lo constituye un compuesto de intercalación de litio en grafito (LiC6).
Al descargarse la batería, el compuesto litio-grafito se transforma en grafito (C6) e iones positivos de litio (Li+), al tiempo que se libera un electrón (e-):
LiC6 → C6 + Li+ + e-
Reacción de reducción (cátodo)
En el cátodo de la batería tiene lugar la reacción de reducción. Se dice que un elemento se reduce cuando gana electrones.
En este electrodo, el óxido de cobalto (CoO2) se combina con los iones de litio y se forma óxido de litio-cobalto (LiCoO2). Para que la reacción tenga lugar, hace falta un electrón (e-):
CoO2 + Li+ + e- → LiCoO2
Reacción completa e interpretación
La reacción completa redox de una batería de grafito y dioxido de cobalto-litio es la siguiente:
LiC6 + CoO2 ⇄ C6 + LiCoO2
Se interpreta de la siguiente manera:
- De izquierda a derecha: descarga de la batería
- De derecha a izquierda: carga de la batería
Así, una vez que todo el óxido de cobalto y el compuesto de intercalación litio-cobalto han reaccionado para transformarse en grafito y dioxido de cobalto-litio, ya no queda energía química que pueda seguir liberando electrones. La batería está agotada.
En ese momento el cargador de la herramienta eléctrica aporta los electrones imprescindibles para la reacción de reducción. Sin ellos sería imposible devolver estos reactivos a la forma que tenían cuando la batería estaba cargada.
Conclusión
La herramienta de batería es tan eléctrica como la de cable. La única diferencia entre ambas es que la cableada toma la electricidad desde el exterior, mientras que la herramienta sin cable almacena su propia energía, en forma química, y, al pulsar el gatillo, la convierte en corriente eléctrica.












